Asit ve bazları iyi kavrayabilmemiz için öncelikle kimyasal tepkimenin ne olduğunu bilmemizde fayda vardır. Bileşikler konusunu okuyarak öğrenebilirsiniz.
Kimyasal tepkimeler
Kimyasal tepkime demek atomların bir araya gelerek yeni bir özellik kazanıp yepyeni bir madde oluşturması veya bileşiklerin elementlerine ayrılması demektir.
H2O Bileşiği aslında hidrojen ile oksijen elementinin arasında kimyasal bağ yaparak oluşmasıdır.
Su yepyeni özellikler kazanmıştır ve hidrojen ile oksijenin özelliğini taşımaz.
H2+O———->H2O
Hidrojen yanıcı özelliktedir. Oksijen yakıcı özelliklerdedir fakat su bu iki özelliğide taşımaz işte bu durum kimlik değişimidir yani kimyasal değişim meydana gelmiştir.
ASİTLER
- Asitler sulu çözeltilerinde H+ iyonu oluşturan maddelerdir.
- Tatları genellikle ekşidir(elma , limon)
- PH değeri 0-7 arasındadır.
- Metallerle kimyasal tepkimeye girerler.
- Metal bir madde asidin içine atılırsa H gazı çıkışı gözlemlenir.
- Mutfaklardaki mermer tezgahlarda limon gibi asitli yiyecekleri kesmek mermeri aşındırır.
- Mavi turnusol kağıdını kırmızıya çevirirler.
Günlük hayatta en çok kullandığımız asitlere örnekler;
- Elma, limon, domates, çilek
- Yoğurt gibi süt ürünleri
- Güçlü bir kimyasal olan tuz ruhu (HCl)
- Sirke, üzüm suyu, turşu
- Güçlü bir kimyasal olan kezzap ve daha bir sürü madde asittir.
Örneklerden de görüldüğü üzere bazı asitleri yiyecek olarak kullanabilirken bazı asitler cildimiz için zararlı ve tahriş edicidir. Bu durumun sebebi asidin gücüdür . PH seviyesi 0 a doğru gittikçe asit güçlü olur 7 ye doğru gittikçe zayıf asit özelliği taşır.
Kimyasal maddenin asit olduğunu nasıl anlarız?
HCl
H2SO4
H3PO4
Genellikle başta olur ve tepkime de H+ Olarak açığa çıkar.
HCl—————->H++Cl örnekte görüldüğü üzere H+ Açığa çıktı
NOT: Zayıf asitler COOH Kökü ile biter. Bu kökü görünce genellikler yiyeceklerde bulunan asitleri anlayabiliriz.
Bazlar
- Sulu çözeltilerinde OH–İyonu açığa çıkarırlar.
- Tatları genellikle acıdır.
- Genellikle temizlik malzemelerinde kullanılır.( sabun şampuan gibi)
- Ele kayganlık hissi verir(Sabunun kayması gibi.)
- kırmızı turnusol kağıdını maviye çevirir.
- PH değer aralığı 7 -14 arasındadır. 14 e yaklaştıkça bazın kuvveti artar. 7 ye doğru yaklaştıkça bazın kuvveti azalır.
Günlük hayatta en çok kullanılan bazlara örnekler;
- Şampuan, sabun, çamaşır suyu gibi kimyasallar
- Diş macunu, kabartma tozu
- Mide ilaçları
- Gübreler
Görüldüğü üzere genellikle kimyasal maddelerde bulunmaktadır.
Kimyasal maddenin baz olduğunu nasıl anlarız
NaOH
Mg(OH)2
Al(OH)3
Sonda olur ve OH kökü bir bütündür suda açığa çıkar.
NaOH————>Na+OH–
NOT: Zayıf asit COOH ile biter baz ile karıştırmayınız.
CH3COOH — Asetik asit — Sirke asidi. baz ile karıştırmayınız.
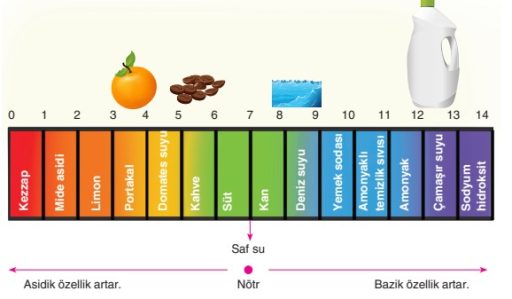
PH METRE

PH metre asit ve bazların değerini gösteren cetveldir
7 ne asittir ne de bazdır nötrdür.
0 a yaklaştıkça asitlik artar 14 e yaklaştıkça bazlık artar.

NÖTRLEŞME
Asit ile bazlar kimyasal olarak tepkimeye girer ve oluşan madde nötr olur. Tepkime sonucu tuz ve su oluşur
NaOH + HCl————————>NaCl+H2O
Baz+ asit—————————->tuz+su
Tuz nötrdür
Asit ve bazlarla işlem yaparken dikkatli olmalıyız. Bazı kuvvettli asit ve bazların karışması solunum yollarımızı etkiler ve kimyasal zehirlenmesine neden olur. Evlerde kullanılan çamaşır suyu(baz) tuz ruhu(asit) karıştırılırsa nefes almamızı önler bu yüzden dikkatli olmalıyız.BAZI ASİTLER VE İSİMLERİ
- Üzüm – tartarik asit
- Sirke – asetik asit
- Elma – malik asit
- Ekşimiş süt ve yoğurt – laktik asit
- Limon – sitrik asit
- Kola ya da gazoz – karbonik asit
- Reçel – sorbik asit
- Çilek – folik asit
- Turşu ya da meyve suyu – benzoik asit
- H2SO4 sülfürik asit(zaç yağı)
BAZI BAZLAR VE İSİMLERİ
- NaOH SODYUM HİDROOKSİT
- NH3 Amonyak(susuz baz)
- HNO3 nitrik asit(kezzap)
AYIRAÇLAR
Asit ve bazları ayırt etmemizi sağlar.
- Turnusol Kağıdı: Çözeltiye batırılan turnusol kırmızı renk olursa asit. mavi renk olursa bazdır.
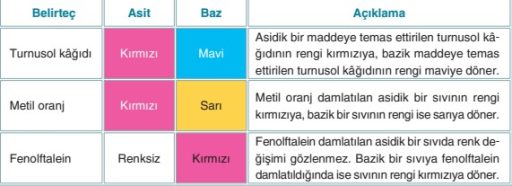
- Kırmızı lahana suyu da iyi bir ayıraçtır ASİTLERİ KIZMIZI, BAZLARI MAVİ YAPAR.
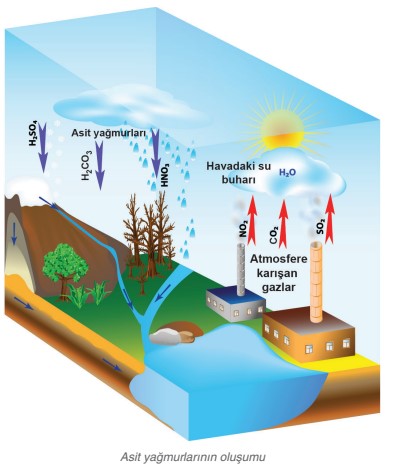
ASİT YAĞMURLARI
Günümüzde elde ettiğimiz enerjinin büyük bir kısmı fosil yakıtlardan elde edilmektedir. Fosil yakıtları doğaya CO2(karbondioksit),SO2(kükürt dioksit). NO2 (azot dioksit) gazları salmaktadır. Doğaya salınan bu gazlar yağmur suyu H2O ile tepkimeye girer ve yağmur suyunun PH seviyesi düşer asitlik özelliği artar.
H2O+CO2——————–>H2CO3(KARBONİK ASİT)
H2O+SO2——————–>H2SO4(SÜLFÜRİK ASİT)
Yağmur suyunun asitlik değeri artmıştır. Yağmur suyunun asitlik değeri artmasının olumsuz etkileri vardır .
- Asit yağmurları araba boyalarına zarar verir.
- Heykel ve tarihi eserlere zarar verir.
- Saçımıza temas ettiği zaman cildimiz için zararlıdır.
- Toprağın asit oranını düşürerek verimini azaltır.
- Denizlerde yaşayan canlılar için zararlıdır.
ZARARINI AZALTMAK İÇİN
- Yenilenebilir enerji kaynaklarının kullanımı artırılmalıdır.
- Bacalara ve araçlara filtre takılmalıdır.
- Büyük kentlerde toplu taşıma yaygınlaştırılmalıdır.
- Araç bakımı zamanında yapılmalıdır.
- Ağaçlandırılan araziler artırılmalıdır.
Bir Cevap Yazın